Estudo das Celas Galvânicas
A pilha de Daniell
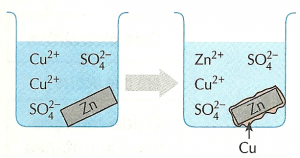
Íons cobre (II), em solução, reagem com uma placa de zinco metálico. São produzidos íons zinco, em solução, e um depósito de cobre metálico. Os íons Cu2+ dão cor azulada à solução. No esquema acima, parte desses íons é consumida na reação com a placa de zinco. (Para visualização, a espessura da camada de cobre foi exagerada.).
Do ponto de vista didático, uma das celas galvânicas cujo funcionamento é mais simples de se entender é a pilha de Daniell, construída pelo cientista inglês John Daniell em 1836, numa época em que a expansão: dos telégrafos com fio exigia fontes de corrente elétrica para uso nesse meio de comunicação.
Será apresentado o raciocínio de Daniell, em linguagem atual. Sabe-se que os íons cobre (II) reagem espontaneamente com o zinco metálico.
![]()
Trata-se de uma reação de óxido-redução em que o zinco sofre oxidação e os íons cobre (II) sofrem redução:

O zinco sofreu oxidação: perdeu elétrons e seu número de oxidação aumentou.
O íon Cu2+ sofreu redução: recebeu elétrons e seu número de oxidação.
Em uma óxido-redução, a espécie que se oxida — o zinco, no caso — transfere elétrons para a que se reduz — os íons cobre (II), no caso. E se conseguirmos fazer com que essa transferência ocorra por meio de ur fio metálico? Seria estabelecida uma corrente elétrica!
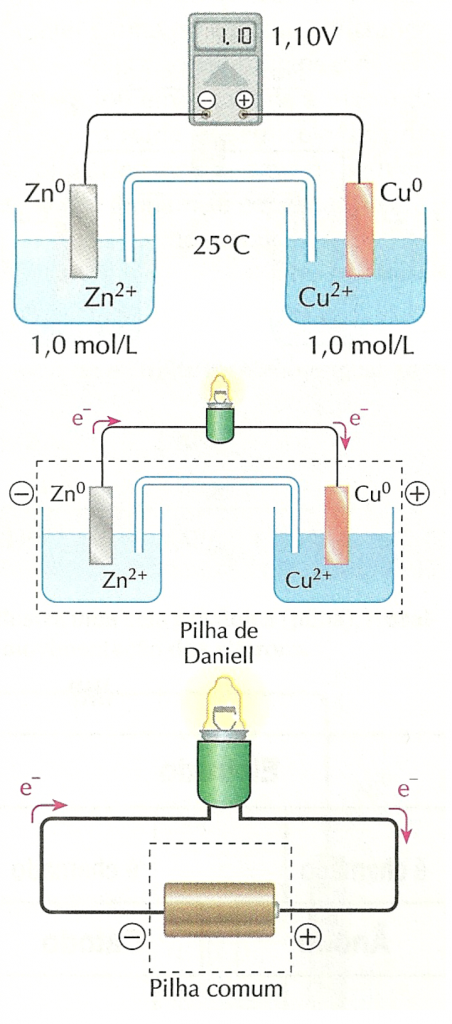
Para conseguir isso, considere uma placa de zinco mergulhada numa solução aquosa contendo 1,0 mol/L de íons zinco (de um sal solúvel de zinco como, por exemplo, sulfato de zinco, ZnSO4). Esse conjunto será denominado semicela (ou meia-cela) e será representado por 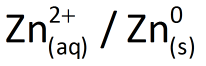 .
.
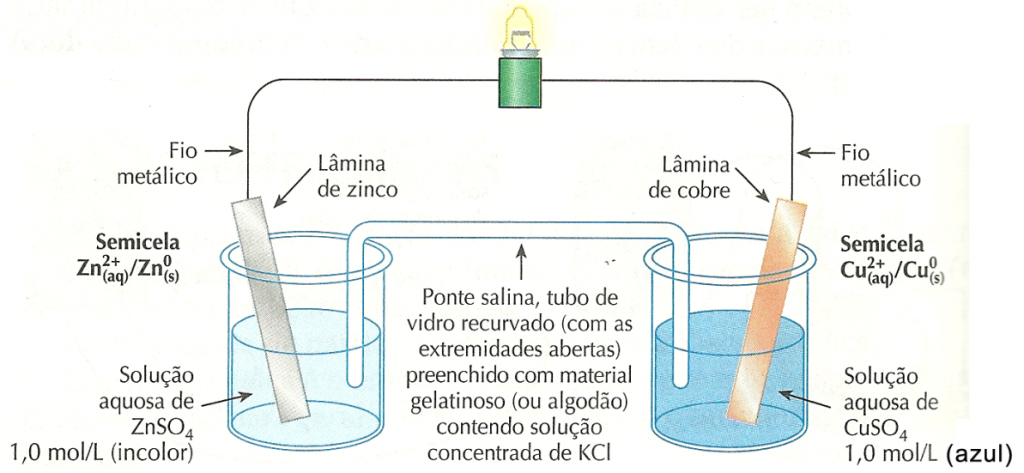
Considere, também, uma placa de cobre mergulhada numa solução aquosa contendo 1,0 mol/L de íons cobre (II) (por exemplo, uma solução de sulfato de cobre (II), CuSO4). Essa semicela é representada por 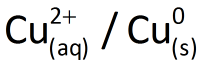 .Ao conectar as placas metálicas de ambos os eletrodos, usando fios metálicos e uma lâmpada (de 1,5 V), e colocar uma ponte salina, verificamos que a lâmpada acende!
.Ao conectar as placas metálicas de ambos os eletrodos, usando fios metálicos e uma lâmpada (de 1,5 V), e colocar uma ponte salina, verificamos que a lâmpada acende!
O funcionamento da pilha de Daniell
Se a lâmpada acendeu é porque o conjunto de eletrodos, fios metálicos e ponte salina forneceram as condições para a movimentação ordenada de cargas elétricas, originando uma corrente elétrica.
O fato de a lâmpada acender também revela que há uma diferença de potencial elétrico entre as placas metálicas de cobre e zinco.Substituindo a lâmpada por um voltímetro, verifica-se (a 25°C e com 1 mol/L de Cu2+ e 1 mol/L de Zn2+) que:
- a diferença de potencial elétrico é de 1,10 V;
- o potencial do eletrodo de cobre é maior que o do eletrodo de zinco.
 Estudos mais detalhados sobre o funcionamento desse dispositivo com a lâmpada e sem o voltímetro) revelam que, com o passar do tempo, à medida que a lâmpada permanece acesa:
Estudos mais detalhados sobre o funcionamento desse dispositivo com a lâmpada e sem o voltímetro) revelam que, com o passar do tempo, à medida que a lâmpada permanece acesa:
- a concentração de íons cobre (II) diminui na solução da direita;
- a concentração de íons zinco aumenta na solução da esquerda;
- a placa de zinco sofre corrosão (desgaste);
- sobre a placa de cobre deposita-se mais cobre metálico.
Esses fatos indicam que elétrons fluem, pelo fio metálico, da placa de zinco (menor potencial) para a de cobre (maior potencial).
Mas como a placa de zinco poderia “emitir” elétrons? O fato de a concentração de íons Zn2+ na solução aumentar e de a placa sofrer corrosão revela que está ocorrendo a oxidação do zinco, que pode ser assim equacionada:

E para onde vão os elétrons recebidos pela placa de cobre? O fato de a concentração de íons Cu2+ diminuir e haver depósito de cobre metálico indica que íons cobre (II) da solução estão sofrendo redução:
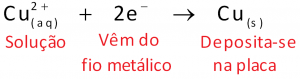
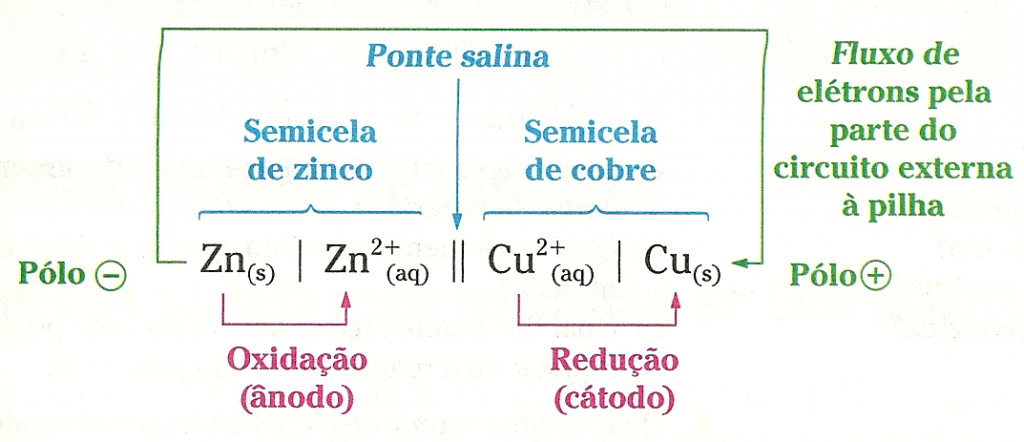
O eletrodo de zinco, por apresentar menor potencial elétrico, atua como o pólo negativo da pilha. E o eletrodo de cobre, que exibe o maior potencial elétrico, atua como pólo positivo. Para entender bem, observe os desenhos ao lado, que permitem comparar a pilha de Daniell com uma pilha de lanterna.
O papel da ponte salina
Cada átomo de Zn0 que manda dois elétrons para o circuito externo sai da placa e passa para a solução na forma de Zn2+, provocando a corrosão da placa e fazendo a solução ficar mais concentrada de íons zinco. Isso tende a fazer com que essa solução fique com excesso de cargas positivas (os íons sulfato, SO2-, não participam da reação). Simultaneamente, a outra solução fica menos concentrada em íons Cu2+ e tende a ter acúmulo de cargas negativas.
Se isso ocorresse, o funcionamento da pilha rapidamente iria cessar, pois o acúmulo de carga positiva na solução da esquerda iria atrair os elétrons do fio metálico para a placa de zinco (cargas de sinais opostos se atraem), e o acúmulo de carga negativa na solução da direita iria repelir os elétrons do fio metálico (cargas de mesmo sinal se repelem), impedindo-os de chegar à placa de cobre.
O acúmulo de cargas elétricas nas soluções é evitado pela ponte salina, um tubo de vidro recurvado preenchido com material gelatinoso e contendo alta concentração de um sal que não interfira no processo; KCl, por exemplo.
O excesso de cátions (portadores de cargas positivas) no frasco da esquerda é compensado pela migração de íons Cl– provenientes da ponte salina em direção ao frasco da esquerda. E o excesso de ânions (portadores de cargas negativas) no frasco da direita é compensado pela migração de íons K+ provenientes da ponte salina em direção ao frasco da direita. Assim, a presença da ponte salina permite que a pilha continue funcionando.
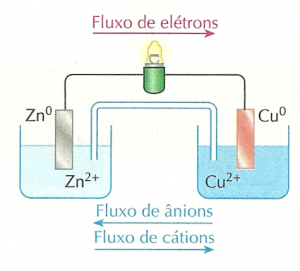 De fato, caso a ponte salina seja retirada, verifica-se que a lâmpada apaga imediatamente. Isso porque o excesso de íons acumulados nas soluções rapidamente impede o fluxo de elétrons através da parte metálica do circuito. É importante perceber que o circuito elétrico inclui o interior da pilha, porém não é um condutor metálico que conduz a corrente dentro dela, mas sim outro tipo de condutor elétrico: soluções aquosas.
De fato, caso a ponte salina seja retirada, verifica-se que a lâmpada apaga imediatamente. Isso porque o excesso de íons acumulados nas soluções rapidamente impede o fluxo de elétrons através da parte metálica do circuito. É importante perceber que o circuito elétrico inclui o interior da pilha, porém não é um condutor metálico que conduz a corrente dentro dela, mas sim outro tipo de condutor elétrico: soluções aquosas.
As soluções de ambos os frascos e também a solução presente na ponte salina permitem que o circuito elétrico esteja totalmente fechado. Lembre-se de que corrente elétrica é um fluxo ordenado de cargas elétricas. No fio metálico, são os elétrons (portadores de carga elétrica negativa) que se movimentam. Nas soluções não são elétrons que se movimentam, mas sim cátions e ânions.
Assim, a experiência de acender uma lâmpada com uma pilha de Daniell envolve um circuito elétrico fechado que consiste basicamente de duas partes: uma parte externa à pilha, formada por fios metálicos, e uma parte interna à pilha, na qual a corrente elétrica que atravessa as soluções aquosas é um fluxo ordenado de cátions e ânions.
Nomenclatura dos eletrodos em uma cela galvânica
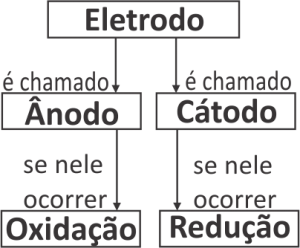 As placas metálicas existentes em uma pilha, que fazem a sua conexão com a parte do circuito elétrico externa à pilha, são denominadas eletrodos. É também frequente, em Química, encontrarmos a palavra eletrodo sendo usada como sinônimo não apenas da placa metálica, mas de toda a semicela.Para todas as celas eletroquímicas, vale a seguinte convenção:
As placas metálicas existentes em uma pilha, que fazem a sua conexão com a parte do circuito elétrico externa à pilha, são denominadas eletrodos. É também frequente, em Química, encontrarmos a palavra eletrodo sendo usada como sinônimo não apenas da placa metálica, mas de toda a semicela.Para todas as celas eletroquímicas, vale a seguinte convenção:
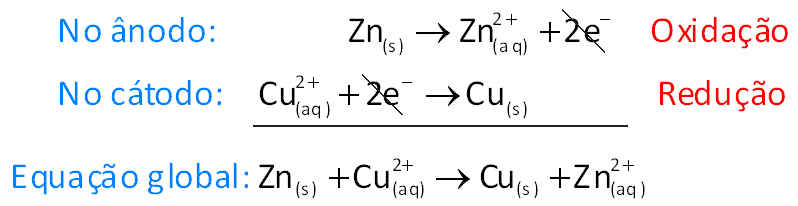
Representação esquemática para uma cela galvânica
A União Internacional de Química Pura e Aplicada (IUPAC) propôs uma maneira esquemática para representar uma cela galvânica. Tal representação é bastante útil, pois permite descrever de modo rápido e simples esse tipo de dispositivo sem a necessidade de desenhá-lo.Vamos exemplificar essa representação para a pilha de Daniell:
Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s)
A barra vertical simples (|) indica a fronteira que separa duas fases, e a barra vertical dupla (||) indica a ponte salina. Do lado esquerdo é representada a semicela em que ocorre a oxidação (ânodo) e, do lado direito, a semicela em que ocorre a redução (cátodo). Assim:
Potencial-Padrão De Semicela
A semicela adotada como referencial em Eletroquímica
A fim de poderem comparar as diversas semicelas, os químicos resolveram medir e tabelar as diferenças de potencial de todas elas em relação a um único referencial. O referencial escolhido para expressar potencial elétrico, em experimentos de Eletroquímica, é o eletrodo-padrão de hidrogênio. Evidências mostraram aos cientistas que a platina (metal nobre, que dificilmente reage com outras substâncias) tem a propriedade de adsorver o gás hidrogênio, ou seja, de reter em sua superfície as moléculas desse gás.
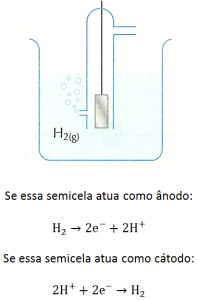 Ao usar a semicela H+/H2, a placa de platina serve como elemento metálico capaz de receber elétrons vindos do circuito externo ou enviar elétrons para ele. As espécies químicas que, de fato, participam do processo de óxido-redução são H2 e H+. Se a semicela H+/H2 atuar com ânodo, a semirreação será a de oxidação de H2 a H+ e, se atuar como cátodo, será a de redução de H+ a H2.
Ao usar a semicela H+/H2, a placa de platina serve como elemento metálico capaz de receber elétrons vindos do circuito externo ou enviar elétrons para ele. As espécies químicas que, de fato, participam do processo de óxido-redução são H2 e H+. Se a semicela H+/H2 atuar com ânodo, a semirreação será a de oxidação de H2 a H+ e, se atuar como cátodo, será a de redução de H+ a H2.
O conceito de potencial-padrão de semicela
A diferença de potencial elétrico entre os pólos de uma cela galvânica, medida com voltímetro numa situação em que a cela não esteja fornecendo corrente elétrica para um circuito, é representado por ΔE. Se essa diferença de potencial for medida nas condições-padrão (convencionadas como 1,0 mol/L e 100 kPa*) e em uma temperatura de interesse (geralmente 25°C), ela é denominada diferença de potencial-padrão e representada por ΔE°. Já sabemos que o potencial elétrico do cátodo é maior que o do ânodo. Assim, podemos dizer que o valor de AE° é dado por:
![]()
 em que
em que 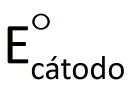 e
e 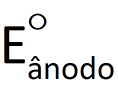 representam, respectivamente, os potenciais elétricos do cátodo e do ânodo.Como já foi dito, o voltímetro não mede valores de potencial, mas sim diferenças de potencial. Assim, não há um modo de medir isoladamente
representam, respectivamente, os potenciais elétricos do cátodo e do ânodo.Como já foi dito, o voltímetro não mede valores de potencial, mas sim diferenças de potencial. Assim, não há um modo de medir isoladamente 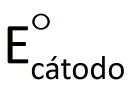 ou
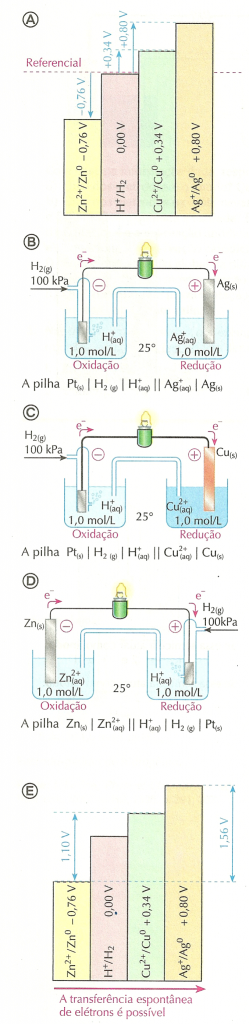
ou 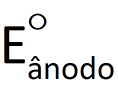 . Apenas medimos a diferença entre ambos (ΔE°).O valor de E° para o eletrodo-padrão de hidrogênio foi convencionado como sendo 0 V (zero volt), quer ele atue como ânodo, quer como cátodo.A partir dessa definição podemos, de acordo com os fatos experimentais, resumidos no esquema , afirmar que:
. Apenas medimos a diferença entre ambos (ΔE°).O valor de E° para o eletrodo-padrão de hidrogênio foi convencionado como sendo 0 V (zero volt), quer ele atue como ânodo, quer como cátodo.A partir dessa definição podemos, de acordo com os fatos experimentais, resumidos no esquema , afirmar que:
- o potencial-padrão da semicela Ag+/ Ag0 é +0,80 V;
- o potencial-padrão da semicela Cu2+/ Cu0 é +0,34 V;
- o potencial-padrão da semicela Zn2+/ Zn0 é -0,76 V.
O potencial-padrão de uma semicela é o valor da diferença de potencial elétrico, nas condições-padrão (1,0 mol/L e 100 kPa) e numa temperatura de interesse (geralmente 25°C), entre o eletrodo dessa semicela e o eletrodo-padrão de hidrogênio.
Interpretação dos potenciais-padrão de semicela
Vimos, no início, que os elétrons se movimentam na parte metálica de um circuito elétrico de um ponto de menor potencial elétrico para um ponto de maior potencial elétrico.
O fato de o potencial-padrão da semicela Ag+/Ag0 ser +0,80 V indica que, na pilha formada por Ag+/Ag0 e H+/H2, o eletrodo de hidrogênio atua como pólo negativo e o de prata, como pólo positivo. Isso porque os elétrons se deslocarão, pelo fio, do eletrodo de hidrogênio (de menor potencial elétrico) para o de prata (de maior potencial). Teremos, para essa pilha, a situação ilustrada esquematicamente na figura (B), ao lado. Há oxidação do H2 e redução dos íons Ag+.
O fato de o potencial-padrão da semicela Cu2+/Cu0 ser +0,34 V indica que, na pilha formada por ela e pela semicela H+/H2, o eletrodo de hidrogênio (menor potencial elétrico) atua como pólo negativo e o de cobre (maior potencial elétrico), como pólo positivo. Assim, teremos a situação mostrada no esquema (C), com a oxidação do H2 e a redução dos íons Cu2+.
No caso da semicela Zn2+/Zn0, a situação se inverte, pois o seu potencial, -0,76 V, é inferior ao do eletrodo-padrão de hidrogênio. O eletrodo de zinco (menor potencial elétrico) funcionará como pólo negativo, emitindo elétrons pelo circuito metálico para o eletrodo de hidrogênio (maior potencial elétrico). A pilha funciona de acordo com o esquema (D), com oxidação do Zn0 e redução dos íons H+.
O esquema (E) resume essa discussão.Quando uma pilha é usada para gerar corrente elétrica em um circuito, os elétrons se movimentam, na parte metálica do circuito, do eletrodo de menor potencial para o de maior potencial elétrico. O esquema (E) também nos permite fazer previsões.
Por exemplo, podemos prever que a diferença de potencial entre as semicelas Cu2+/ Cu0 e Zn2+/ Zn0, que tomam parte da pilha de Daniell, é de 1,10 V. Ao comparar, no esquema (E), as semicelas Zn2+/Zn0 e Ag+/Ag0, percebemos que a diferença de potencial-padrão entre ambas é de 1,56 V, sendo que o potencial da semicela de prata é maior que o da semicela de zinco. Ambas semicelas formariam, portanto, uma pilha com diferença de potencial elétrico de 1,56 V, na qual o pólo negativo é o eletrodo de zinco e o pólo positivo é o eletrodo de prata. Essa previsão também é confirmada experimentalmente!
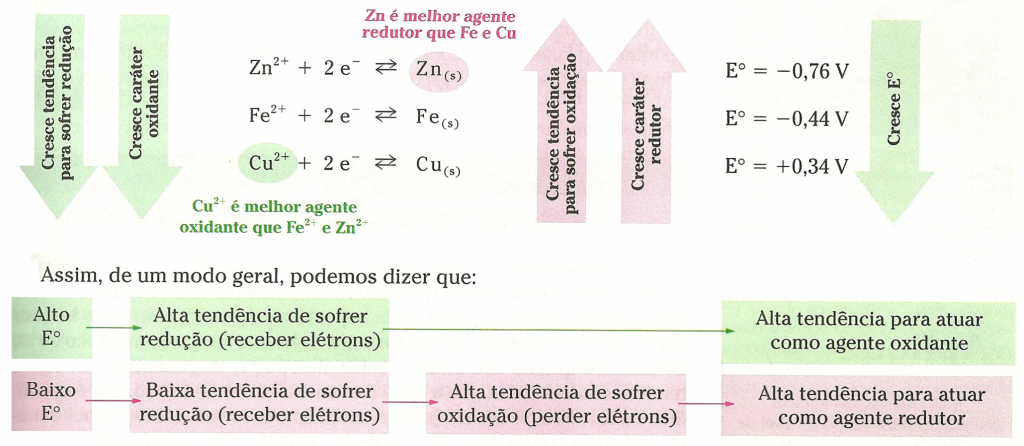
Podemos concluir que, quanto maior o potencial-padrão de uma semicela, maior é a tendência de ela receber elétrons e de nela acontecer redução.
Quanto maior o potencial-padrão de uma semicela (E°), maior a tendência de ela receber elétrons, ou seja, maior a tendência de nela ocorrer redução. Por isso, essa grandeza também é conhecida como potencial-padrão de redução e simbolizada por Eoredução.
Aplicações Da Tabela De Potenciais-Padrão
Previsão da força eletromotriz de uma pilha
A força eletromotriz de uma pilha é a diferença de potencial elétrico medida entre os seus terminais, quando ela não está sendo usada para gerar corrente. Quanto maior o valor dessa grandeza (representada por ΔE°), maior a capacidade de a pilha gerar corrente elétrica.
![]()
Por exemplo, no caso da pilha de Daniell, temos:E° = E°(Cu2+/ Cu0) – E°(Zn2+/Zn0) = +0,34 V – (-0,74 V) = 1,10 V
Comparação da força de oxidantes e redutores
Espontaneidade de reações de óxido-redução
Numa reação de óxido-redução que ocorra espontaneamente, os elétrons são transferidos de uma espécie química com menor potencial de redução para outra com maior potencial de redução. Portanto, se calcularmos a diferença de potencial para esse processo, chegaremos a um valor positivo.Reação de óxido-redução espontânea:
![]()
Reação de óxido-redução não-espontânea:
![]()
Veja os cálculos:

A proteção de uma superfície metálica
O ferro na presença de água isenta de ar (ausência de gás oxigênio) ou na presença de ar seco (ausência de umidade) praticamente não enferruja (ausência de corrosão). Contudo, o que ocorre normalmente é o ferro ficar exposto à água contendo oxigênio dissolvido, e é aí que está o problema.As equações a seguir representam o que acontece na corrosão do ferro (ou do aço, uma liga de ferro com um pouco de carbono) na presença de água que contenha oxigênio dissolvido ou na presença de ar úmido.
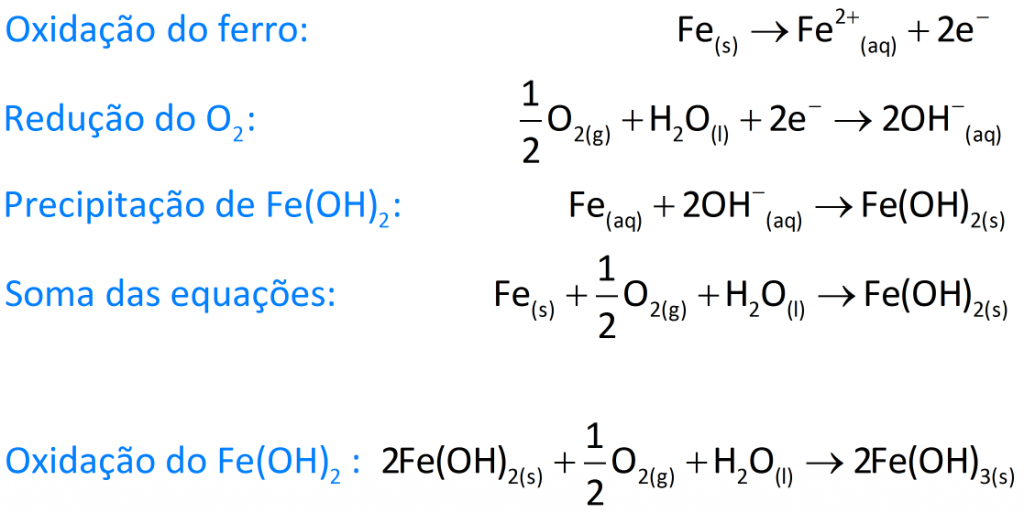
A ferrugem, que pode ser encarada como uma mistura de Fe(OH)2 e Fe(OH)3, ao ser formada na superfície do ferro ou do aço, solta-se em flocos, deixando o ferro novamente exposto e sujeito à oxidação.Um procedimento possível para proteger o ferro da corrosão em ambientes nos quais esteja exposto à água e ao gás oxigênio é a galvanização. Galvanizar o ferro ou o aço consiste em revesti-los com zinco metálico (como se fosse uma fina película de tinta) para evitar sua corrosão. O zinco foi escolhido por ser um redutor mais forte que o ferro. Vejamos:
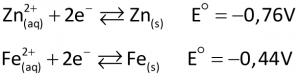
O zinco reveste a superfície do ferro como se fosse uma camada de tinta, impedindo seu contato com o ar úmido ou com a água que contém oxigênio. Esse zinco também atua, diante do ferro, como se fosse o ânodo de uma pilha.Se o ferro galvanizado fosse “riscado” e exposto ao ar e à umidade, ele estaria sujeito a ser oxidado a Fe2+. Este seria imediatamente reduzido a Fe pelo zinco, impedindo o aparecimento da ferrugem.
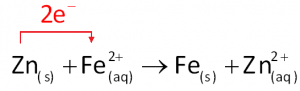
Porém, como o zinco tem mais facilidade para se oxidar que o ferro (pois tem menor potencial de redução), ele tende a se oxidar preferencialmente, mesmo que o ferro esteja exposto. Em outras palavras, se a película protetora de zinco for danificada e o ferro estiver exposto, o zinco atuará como metal de sacrifício, ou seja, um metal propositalmente colocado em contato com o ferro para que seja oxidado em lugar dele, preservando-o.



