Considere, inicialmente, uma molécula de CHBrClF, de geometria tetraédrica, que não apresenta nenhum plano de simetria. Uma molécula desse tipo é chamada de molécula assimétrica ou molécula quiral. Se a colocarmos diante de um espelho, a imagem especular será diferente dela.
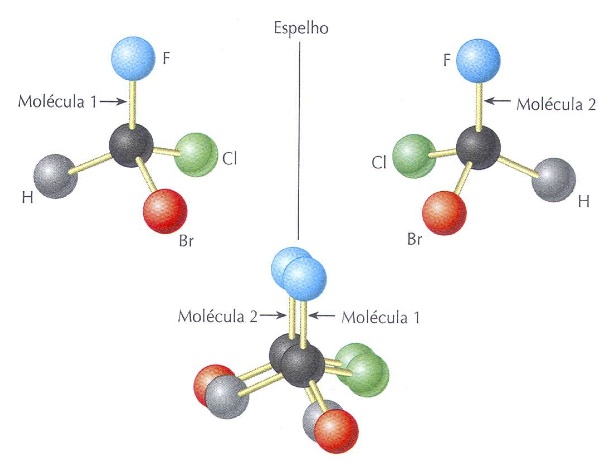
Esquema mostrando uma molécula de fórmula molecular CHBrClF e sua imagem especular, que é diferente dela. As moléculas 1 e 2 (ambas de fórmula molecular CHBrClF) são diferentes. Isso é percebido ao aproximarmos as moléculas.
- Esse tipo de isomeria, em que uma molécula é a imagem especular da outra, é chamado de isomeria óptica. Os isômeros são chamados de isômeros ópticos ou enantiomorfos ou, ainda, enantiômeros. Trata-se do caso mais sutil de isomeria, que ocorre com moléculas sem nenhum plano de simetria.
A isomeria óptica acontece apenas com as substâncias que têm moléculas assimétricas. Mas, olhando para a fórmula estrutural plana, como perceber que a molécula é assimétrica?
Para responder a essa pergunta, considere as moléculas a seguir. Nenhuma delas possui quatro ligantes diferentes no carbono. Todas possuem pelo menos um plano de simetria e, portanto, fornecem uma imagem especular igual a si mesmas.
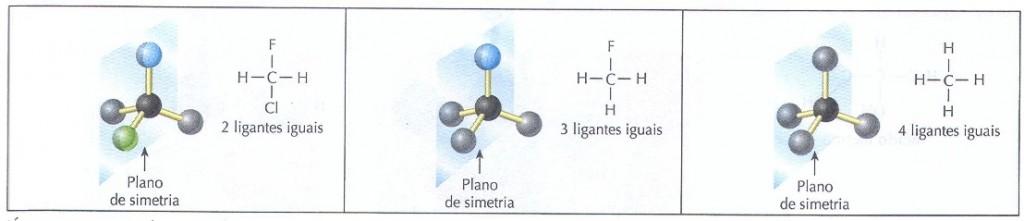
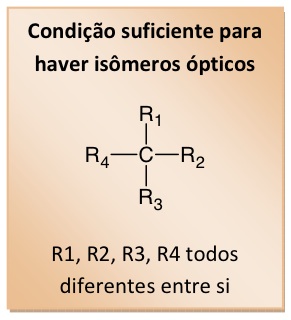
Por tudo o que acabamos de mostrar, é possível concluir que a assimetria molecular estará presente se houver na estrutura um carbono que faça quatro ligações simples e que esteja ligado a quatro grupos diferentes. O carbono em questão é chamado de carbono assimétrico, carbono quiral ou centro quiral.
Em uma estrutura, a presença de um único carbono quiral permite que a substância possua isômeros ópticos. Costuma-se usar um asterisco (*) para destacar esse carbono. Alguns exemplos de moléculas contendo carbono quiral aparecem abaixo.
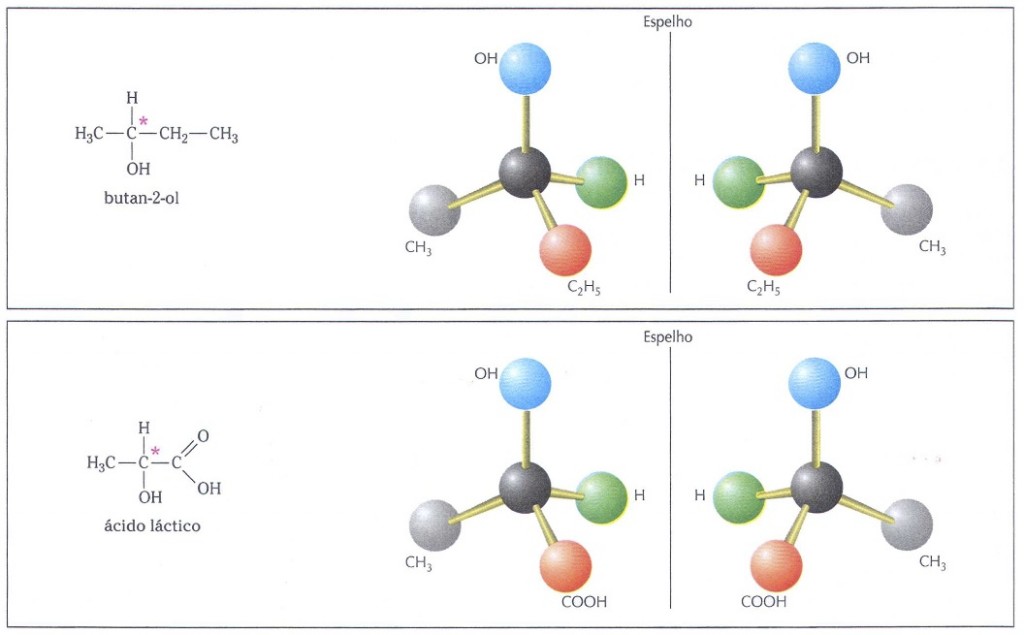
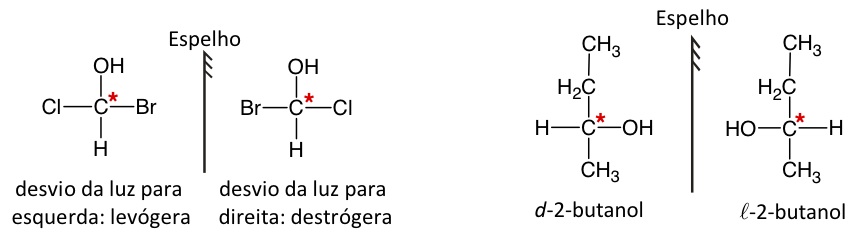
Misturas equimolares de destrórigos (+) e levógiros (–) são chamadas de misturas racêmicas, não desvia o plano da luz polarizada. É uma mistura opticamente inativa.
Substância com dois carbonos quirais: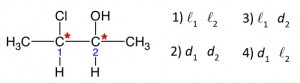
Esta substância possui 4 isômeros que desviam a luz (IOA) e duas misturas racêmicas (OI) possíveis.
Como calcular o número de Isômeros Opticamente Ativos (IOA):![]()
Como calcular o número de Isômeros Opticamente Inativos (IOI):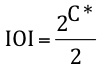
C* é o número de carbonos quirais.
Atenção!
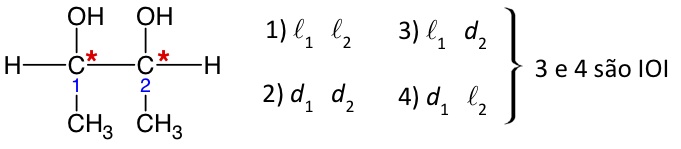
A Luz Polarizada
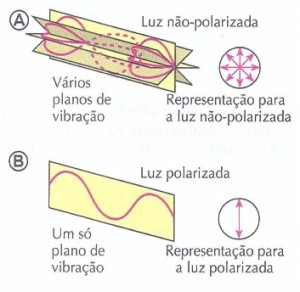
Quando uma lâmpada emite luz, na verdade ela está emitindo muitas ondas de luz, que vibram em vários planos. Isso é conhecido pelos cientistas como luz não-polarizada (figura A). Existem lentes especiais, chamadas de polarizadores, capazes de fazer com que a luz, ao atravessá- las, sofra o fenômeno da polarização, que consiste em fazê-la passar a vibrar em um só plano. É a chamada luz polarizada (figura B).
Ao colocar dois polarizadores no caminho de um raio de luz, se eles estiverem alinhados (isto é, colocados de maneira que a direção de polarização seja a mesma), haverá passagem de luz por eles. Caso um deles esteja orientado com a direção de polarização perpendicular à do outro, isso dificultará muito a passagem de luz.
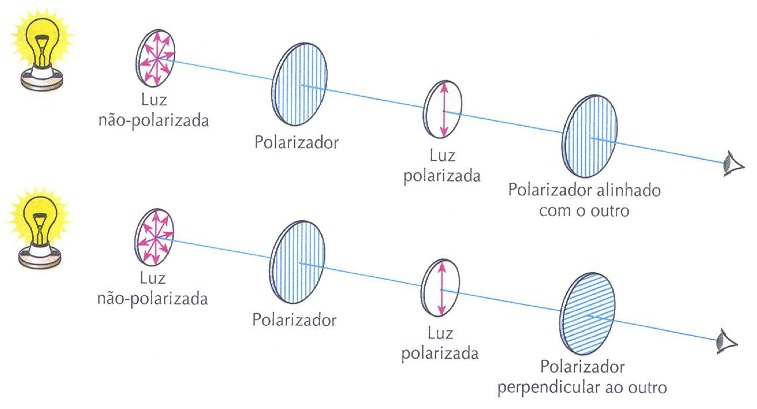
No esquema ao lado, o observador é capaz de enxergar a luz que vem da lâmpada. Dois polarizadores alinhados permitem a passagem da luz.
Neste esquema, o observador não é capaz de enxergar a luz que vem da lâmpada ou a enxerga com pequeníssima intensidade. Dois polarizadores colocados de modo perpendicular um ao outro impedem ou dificultam tremendamente a passagem da luz.
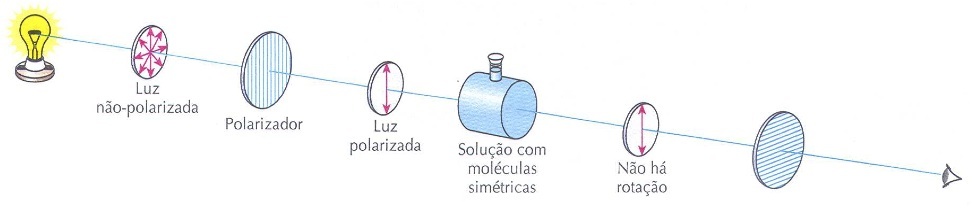
Ao passar por um tubo contendo apenas moléculas simétricas, o plano da luz polarizada não sofre desvio (rotação). Dizemos que as moléculas simétricas são opticamente inativas.
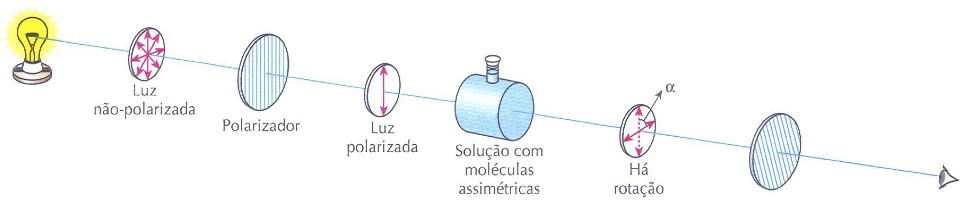
Ao passar por um tubo contendo moléculas assimétricas, o plano da luz polarizada sofre desvio (rotação). Dizemos que as moléculas assimétricas são opticamente ativas. Se o desvio ocorre no sentido horário (como o mostrado nesse esquema), a substância é dextrorrotatória. Caso o desvio seja no sentido anti-horário, a substância é levorrotatória.
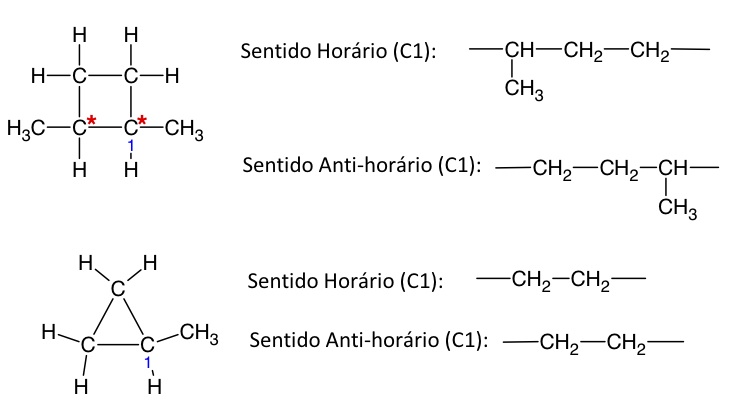
Isomeria óptica em compostos cíclicos
Condições para haver isomeria óptica em compostos cíclicos:
- Não deve existir simetria no clico. Exemplo:
 Não há isomeria óptica
Não há isomeria óptica
- Cada carbono deve possuir ligantes diferentes fora do ciclo.
- A análise do ciclo no sentido horário de ser diferente daquela feita no sentido anti-horário. Exemplo: